నైట్రస్ ఆమ్లం
| |
| పేర్లు | |
|---|---|
| Preferred IUPAC name
Nitrous acid | |
| Systematic IUPAC name
Hydroxidooxidonitrogen | |
| గుర్తింపు విషయాలు | |
| సి.ఎ.ఎస్. సంఖ్య | [7782-77-6] |
| పబ్ కెమ్ | 24529 |
| యూరోపియన్ కమిషన్ సంఖ్య | 231-963-7 |
| కెగ్ | C00088 |
| వైద్య విషయ శీర్షిక | Nitric+acid |
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:25567 |
| SMILES | O=NO |
| జి.మెలిన్ సూచిక | 983 |
| 3DMet | B00022 |
| ధర్మములు | |
| HNO2[1] | |
| మోలార్ ద్రవ్యరాశి | 47.013 g/mol[1] |
| స్వరూపం | Pale blue solution |
| సాంద్రత | Approx. 1 g/ml |
| ద్రవీభవన స్థానం | Only known in solution |
| ఆమ్లత్వం (pKa) | 3.398 |
| ప్రమాదాలు | |
| జ్వలన స్థానం | {{{value}}} |
| సంబంధిత సమ్మేళనాలు | |
| ఇతరఅయాన్లు | {{{value}}} |
ఇతర కాటయాన్లు
|
Sodium nitrite Potassium nitrite Ammonium nitrite |
సంబంధిత సమ్మేళనాలు
|
Dinitrogen trioxide |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
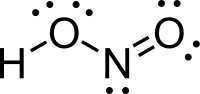
నైట్రస్ ఆమ్లం ఒక బలహీనమైన మోనోబేసిక్ ఆమ్లం. నైట్రస్ ఆమ్లంతో అమినుల/అమైనుల(amines)నుండి డైఅజిడుల(azide)ను ఉత్పత్తి చేస్తారు. నైట్రైట్ లమీద అమినులు న్యూక్లియోఫిలిక్(nucleophilic)దాడి వలన, అజిడులు ఏర్పడతాయి.
నిర్మాణం
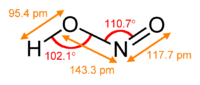
[మార్చు]వాయుస్థితిలో సమతల ఆకృతి కలిగిన నైట్రస్ ఆమ్లం అణువు సిస్(cis), ట్రాన్స్(trans)రూపాలను రెండింటిని కలిగి ఉంటుంది. గది ఉష్ణోగ్రత వద్ద ట్రాన్స్స్థితి ఆధిక్యత కనపరుస్తుంది. ఇన్ఫ్రారెడ్ కొలమానం (IR measurements) ప్రకారం 2.3kJ/మోల్-1 వద్ద చాలా స్థిరమైనది.
 |
 |
 |
(from the microwave spectrum) |
ఉత్పత్తి
[మార్చు]చల్లని నైట్రైట్ అయాన్ కల్గిన ద్రావణాలను జాగ్రత్తగా ఆమ్లీకరించిన(acidify), లేత ప్రకాశవంత నీలి నైట్రస్ ఆమ్లద్రావణం ఏర్పడును. స్వేచ్ఛా నైట్రస్ ఆమ్లం అస్థిరమైనది, వేగంగా వియోగం చెందుతుంది.
వియోగం
[మార్చు]బాగా చల్లగా ఉన్న, సజల(పలుచని) ద్రావణంగా మినహాయించి నైట్రస్ ఆమ్లం చాలావేగంగా నైట్రోజన్ ఆక్సైడ్, నైట్రిక్ ఆక్సైడ్, నీరుగా విడిపోతుంది[2].
- 2 HNO2 → NO2 + NO + H2O
నైట్రోజన్ డయాక్సైడ్ సజల ద్రావణాలలో అసమతుల్యతవిభజన(disproportionate) చెందటంవలన నైట్రిక్ ఆమ్లం, నైట్రస్ ఆమ్లం ఏర్పడును[3].
- 2 NO2 + H2O → HNO3 + HNO2
అలాగే వెచ్చగాఉన్న, గాఢత ఉన్న ద్రవాలలో చర్య ఫలితంగా నైట్రిక్ ఆమ్లం, నీరు, నైట్రిక్ ఆక్సైడు ఏర్పడును.
- 3 HNO2 → HNO3 + 2 NO + H2O
రసాయన చర్యలు
[మార్చు]అకర్బన పదార్థాలతో చర్యలు
[మార్చు]నైట్రస్ ఆమ్లంను క్షయీకరించడం వలన, క్షయికారణకారకాన్ని బట్టి వివిధరసాయన పదార్థ ఉత్పత్తులు ఏర్పడును[4].
I−, Fe2+ అయానులలో క్షయికరన వలన నైట్రిక్ ఆక్సైడ్ ఏర్పడును.
- 2HNO2 + 2 KI + 2 H2SO4 → I2 + 2 NO + 2 H2O + 2 K2SO4
- 2 HNO2 + 2 FeSO4 + 2 H2SO4 → Fe2(SO4)3 + 2 NO + 2 H2O + H2SO4
Sn2+ అయాన్ తో N2O ఏర్పడును.
- 2HNO2 + 6HCl + 2 SnCl2 → 2SnCl4 + 2N2O + 6H2O + 2HCl
సల్ఫర్ డయాక్సైడు వాయువుతో NH2OH ఏర్పడును
- 2HNO2 + 6H2O + 4SO2 → 3 H2SO4 + H2SO4 + 2 NH2OH
క్షారద్రావణంలో జింకుతో NH3 ఏర్పడును
- 5H2O + HNO2 + 3 Zn → NH3 + KOH + 3Zn(OH)2
N2H5+, HN3లతో క్షయికరణ వలన నైట్రోజన్ వాయువు వెలువడును.
- HNO2 + [N2H5]+ → HN3 + H2O + H3O+
- HNO2 + HN3 → N2O + N2 + H2O
నైట్రస్ ఆమ్లం వలన జరిగే ఆక్సీకరణ చర్యలో థెర్మోడైనమిక్ మియంత్రణ పై కినేటిక్ నియంత్రణ ఆధిక్యత కనపరచును.అందువలననే సజలనైట్రిక్ ఆమ్లం అయోడైడ్(I−)ను అయోడిన్(I2)గా అక్సికరించ గలదు. సజల నైట్రిక్ ఆమ్లం తోఇలాజరుగదు.
- I2 + 2 e− ⇌ 2 I− {Eo = +0.54 V}
- NO3− + 3H+ + 2 e− ⇌ HNO2 + H2O {Eo =+0.93 V}
- HNO2 + H+ + e− ⇌ NO + H2O {Eo = +0.98 V}
పై రెండు రసాయన చర్యలను గమనించిన రెండు ఆమ్లాల Ecello విలువ సమానమే,కాని నైట్రిక్ ఆమ్లం ఎక్కువ ఆక్సీకరకారకం.వాసవానికి సజల నైట్రస్ ఆమ్లం నైట్రిక్ ఆమ్లం కన్న వేగంగా అయోడైడ్ను అయోడిన్గా ఆక్సీకరించడంగమనించవచ్చును[4].
సేంద్రియ రసాయన శాస్త్ర పరిధిలో వినియోగం
[మార్చు]డై అజోనియం లవణాలను ఉత్పత్తి చేయ్యుటకై నైట్రస్ ఆమ్లాన్ని ఉపయోగిస్తారు.
- HNO2 + ArNH2 + H+ → ArN2++2H2O
ఇక్కడ Ar పదం అరైల్(aryl)సమూహాన్ని/గుంపును సూచిస్తున్నది.
విషగుణం, విస్పోటనలక్షణాలుఉన్న సోడియం అజైడ్(sodium azide)ను నైట్రస్ ఆమ్లం నాశనం చేస్తుంది[5].
సోడియం నైట్రైట్లతో ఖనిజఆమ్లాలు చర్యవలన నైట్రస్ ఆమ్లం ఉత్పత్తి అగును.
- NaNO2 + HCl → HNO2 + NaCl
- 2NaN3 + 2 HNO2 → 3 N2 +2NO + 2NaOH
కిటోనులలోని α-హైడ్రోజన్ పరమాణువు లతో ఆక్సిమేస్(oximes)లను ఏర్పరచును.అక్సిమేస్ లు మరింత ఆక్సీకరణ చెందటం వలన కార్బోలిక్ ఆమ్లాలు ఏర్పడును,లేదా క్షయికరణ వలన అమినులు ఏర్పడును.ఈ చర్యావిధానం ద్వారా వాణిజ్య పరంగా అడిపిక్ ఆమ్లాన్ని తయారు చేయుదురు.నైట్రస్ ఆమ్లం చురుకుగా, వేగంగా అలిపాటిక్ ఆల్కహాల్లతో చర్య జరిపి అల్కైల్ నైట్రైటులను ఏర్పరచును.
- (CH3)2CH-CH2-CH2-OH + HNO2 → (CH3)2CH-CH2-CH2-ONO + H2O
భూవాతవరణం పై ప్రభావం
[మార్చు]నైట్రస్ ఆమ్లం దిగువ వాతావరణంలో ఓజోన్ పొరపై ప్రభావం చూపును. నైట్రిక్ ఆక్సైడ్ (NO), నీటి విజాతీయ స్పందన నైట్రస్ ఆమ్లం ఉత్పత్తి చేస్తుంది. ఈ చర్య వాతావరణ తుంపరల ఉపరితలంపై జరుగుతుంది ఉన్నప్పుడు,ఉత్పాదితాలు హైడ్రాక్సిల్ రాడికలులుగా కాంతివిశ్లేషణ చెందుతుంది.[2]
ఆధారాలు/మూలాలు
[మార్చు]- ↑ 1.0 1.1 "NITROUS ACID". pubchem.ncbi.nlm.nih.gov. Retrieved 2015-09-16.
- ↑ 2.0 2.1 "Nitrous acid". newworldencyclopedia.org. Retrieved 2015-09-16.
- ↑ Kameoka, Yohji; Pigford, Robert (February 1977). "Absorption of Nitrogen Dioxide into Water, Sulfuric Acid, Sodium Hydroxide, and Alkaline Sodium Sulfite Aqueous". Ind. Eng. Chem. Fundamen. 16 (1): 163–169. doi:10.1021/i160061a031.
- ↑ 4.0 4.1 Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry, 3rd Edition. Pearson. p. 449. ISBN 978-0-13-175553-6.
- ↑ Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. 1995. ISBN 0-309-05229-7.